《金证研》南方资本中心 羲和/作者 肖直 西洲 映蔚/风控
早在2021年8月18日,深圳北芯生命科技股份有限公司(以下简称“北芯生命”)曾向港交所递交招股书,而后无进展更新。2022年10月17日,北芯生命签署上市辅导协议,拟于科创板挂牌上市。
此番冲击科创板,北芯生命核心产品与竞品相比,或存测量费用高、诊断准确度低等“短板”。不仅如此,招股书中披露的该产品的诊断准确度高于论文及官网数据,产品关键技术指标信披现“罗生门”。需要指出的是,北芯生命主营业务收入来源于上述核心产品中的耗材,而招股书披露的耗材产能数据与环评报告矛盾。
一、核心产品临床诊断指标不及竞品测量费用反更高,竞争力或现“短板”
“血流储备分数”(Fractional Flow Reserve,以下简称“FFR”),是指在心肌最大充血态下,冠状动脉内狭窄远端平均压与冠状动脉口部主动脉平均压的比值,用以确定狭窄处血液供应至心肌的程度。
值得关注的是,作为核心产品,北芯生命所研发的测量FFR的产品,与竞争对手的同类产品相比,在有创性、手术时间、诊断准确度等指标上或均不占优势。
1.1“FFR系统”系北芯生命核心产品之一,贡献超九成主营业务收入
据北芯生命签署日为2023年3月24日的招股说明书(以下简称“招股书”),北芯生命主要从事心血管疾病精准诊疗创新医疗器械研发、生产和销售的业务。
截至招股书签署日2023年3月24日,北芯生命累计向市场推出4个产品。其中的2个产品为北芯生命的核心产品,分别为血管内超声(即Intravascular Ultrasound)诊断系统(以下简称“IVUS系统”)、血流储备分数(FFR)测量系统(以下简称“FFR系统”)。
其中,“FFR系统”通过“直接测量FFR”使医生可对冠状动脉疾病患者的心肌缺血程度进行精准诊断,定位导致患者缺血的狭窄病变位置,指导后续PCI治疗策略及进行术后疗效评估,是北芯生命血管内功能学产品线的代表产品。
2019年2月,北芯生命“FFR系统”获批进入国家创新医疗器械特别审查程序;2020年3月,“FFR系统”取得CE认证并进入海外市场;2020年9月,“FFR系统”获批国家药监局第三类医疗器械注册并实现国内销售。
从“FFR系统”结构来看,“FFR系统”由“TREPHYSIO® FFR压力微导管”(以下简称“FFR压力微导管”)和“VivoCardio®血流储备分数测量设备”(以下简称“FFR主机”)两部分组成。
2020-2021年及2022年1-9月,北芯生命主营业务收入分别为158.76万元、5,162.24万元、6,077.74万元。其中,“FFR压力微导管”的销售收入分别为139.86万元、4,892.58万元、5,922.75万元,“FFR主机”的销售收入分别为18.9万元、269.66万元、66.6万元。
经《金证研》南方资本中心计算,2020-2021年及2022年1-9月,“FFR系统”(即“FFR压力微导管”+“FFR主机”)的销售收入分别为158.76万元、5,162.24万元、5,989.35万元,占主营业务收入的比例分别为100%、100%、98.55%。
也就是说,北芯生命的核心产品“FFR系统”是主营业务收入的主要来源。
然而,北芯生命的“FFR系统”在与同类产品的竞争中或落于下风。
1.2 “FFR系统”属于“直接测量FFR”,与“基于造影计算类的FFR”存竞争
据招股书,北芯生命的“FFR系统”属于指导PCI金标准的“直接测量FFR”,适用于需精准诊断心肌缺血的冠状动脉疾病患者。
对于细分市场竞争格局,北芯生命在招股书中对国内已获批“冠脉直接测量FFR”产品的竞争格局进行了披露。
据招股书,根据形态及产品临床定位的不同,提供FFR评估的产品总体可分为“直接测量FFR”、“基于影像的FFR”。其中,“基于影像的FFR”主要包括“基于CT血管造影术的FFR”、“基于血管造影的FFR”等。而“基于血管造影的FFR”亦称为“基于造影计算类的FFR”。
需要指出的是,“直接测量FFR”和“基于造影计算类的FFR”均在冠状动脉疾病患者进行冠脉造影检查后进行,存在竞争关系;而“基于CT血管造影术的FFR”则用于开展心肌缺血筛查,后续仍需进行冠脉造影检查及金标准指导工具才能确诊。因此“基于CT血管造影术的FFR”不与“直接测量FFR”和“基于血管造影的FFR”形成竞争关系。
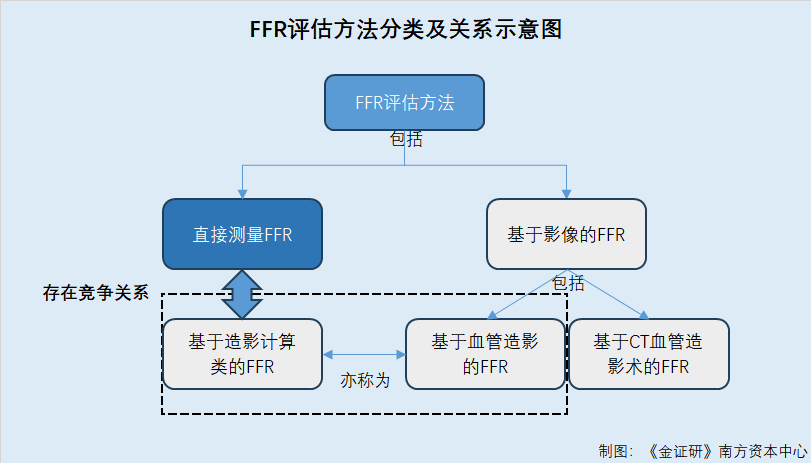
也就是说,北芯生命的“FFR系统”除了与同属于“直接测量FFR”的其他产品存在竞争外,还与“基于造影计算类的FFR”产品存在竞争关系。
值得一提的是,市场上已有“基于造影计算类的FFR”的产品。
1.3 润迈德与博动医疗各有一款产品,属于“基于造影计算类的FFR”
据苏州润迈德医疗有限公司(以下简称“润迈德”)官网,润迈德产品“闪影caFFR系统”(FlashAngio caFFR System,以下简称“caFFR系统”)是冠状动脉造影血流储备分数测量系统。该系统可根据两幅造影图像还原血管三维模型、通过TIMI计帧法获得血流速度,结合实时主动脉压力和优化计算流体力学方法算出FFR值。
据上海博动医疗科技股份有限公司(以下简称“博动医疗”)官网,博动医疗产品“QFR®”,即定量血流分数检测仪(以下简称“QFR”)是其原创的基于冠脉造影的计算冠脉生理学和PCI手术规划产品。
不难发现,润迈德“caFFR系统”与博动医疗“QFR”均属于“基于造影计算类的FFR”,与北芯生命的核心产品“FFR系统”之间存在竞争关系。
而与上述两家竞争对手相比,北芯生命“FFR系统”或不占优势。
1.4 耗材价格影响患者使用意愿,竞争对手产品所需费用低于北芯生命
据招股书,北芯生命“FFR系统”中的“FFR压力微导管”为一次性使用耗材,“FFR主机”则可重复使用。
再来看润迈德“caFFR系统”、博动医疗“QFR”的构成。
据润迈德2022年6月27日发布的招股章程(以下简称“润迈德招股书”),润迈德“caFFR系统”由两部分组成,即控制台(FlashAngio caFFR系统)及其专有一次性耗材(FlashPressure caFFR压力传感器)。
据博动医疗2022年2月11日发布的招股章程申请版本(以下简称“博动医疗招股书”),博动医疗“QFR”第一代产品“QFR V1”仅由一个移动式控制台组成,无需耗材。
需要指出的是,据润迈德招股书,耗材通常由患者自付费用,因此耗材价格将影响患者的使用意愿。
据润迈德招股书,北芯生命“FFR系统”的耗材价格为13,000至17,000元。此外,使用有微导管的FFR测量产品时需要进行腺苷注射,而该等额外注射将对患者产生额外成本。
反观润迈德,据润迈德2022年年报,截至2022年12月31日,润迈德已在30个省和地区就“caFFR系统”专有耗材获得患者自费价格,价格为10,200元至12,000元,其中21个省和地区(例如上海、广东、重庆、河南等)亦将“caFFR系统”专有耗材纳入医疗保险报销清单。
而据博动医疗招股书,博动医疗“QFR”产品无需耗材,患者一次“QFR”测量的平均费用约为2,900元至约4,200元之间。
可见,患者在使用博动医疗的“QFR”产品进行测量的平均费用,低于北芯生命“FFR”系统中的一次性耗材的费用,具备价格优势;另外,对于同样需要耗材的润迈德的“caFFR系统”,不仅患者自费购买耗材的价格较北芯生命的“FFR系统”产品更低,还被纳入了医疗保险报销清单,同样具备价格优势。
值得注意的是,除价格外,北芯生命的“FFR系统”在其他方面的竞争力,或也遭拷问。
1.5 相较竞品,北芯生命“FFR系统”手术操作更加复杂且具有额外创伤性
先来看北芯生命的“FFR系统”所属的“直接测量FFR”的技术特点。
据博动医疗招股书,使用压力导丝或压力微导管等有创工具评估FFR值的FFR技术为有创FFR,在手术过程中存在潜在的并发症风险。
据润迈德招股书,压力微导管是一种介入性测量方法,利用光纤通讯技术,以远程带有压力传感器的导管来检测病变。与传统基于导丝的FFR类似,使用压力微导管的FFR程序通常需要大约15至30分钟,且操作复杂,医生学习周期较长,其诊断准确率依赖医生的资历、经验及操作技巧。
也就是说,使用压力微导管的北芯生命的“FFR系统”,所采用的测量方法属于有创FFR,不仅存在并发症风险,还具有耗时长、操作复杂、医生学习周期长、对医生资历具有依赖性等不足。
相对的,使用博动医疗的“QFR”产品与润迈德的“caFFR系统”产品,或造成的创伤更小,操作更加简单,所需手术时间也更短。
前文提到,博动医疗的“QFR”产品与润迈德的“caFFR系统”产品均属于“基于影像的FFR”。
据博动医疗招股书,“基于影像的FFR”(即上述“基于造影计算类的FFR”)测量基于影像数据,不需要使用压力导丝或微导管,而且并无额外有创性。
据润迈德招股书,caFFR是一种微创性测量法,基于血管造影重建的冠状动脉三维图像可快速、准确地确定FFR值。在caFFR程序期间,实时主动脉血压波形将由非介入式压力传感器采集,FFR值则据此通过设计好的计算流体动力学算法计算得出。相较传统基于导丝的FFR程序,由于在CAG之后,caFFR测量不会产生其他切口,且无需联合有创压力导丝使用,故微创不仅使caFFR成为更安全的解决方案,亦简化了测量程序,让护士或技术人员亦能轻松处理。caFFR程序可在五分钟之内完成。
而“QFR”是一种能够从三维定量冠状动脉造影和心肌梗死溶栓帧计数中有效计算FFR的新方法。作为一种微创性测量方法,相较基于导丝的FFR程序,“QFR”更为安全且易于操作。“QFR”测量程序可在五分钟之内完成。
即是说,润迈德“caFFR系统”与博动医疗“QFR”均为微创,且平均手术时间均在五分钟之内,具有安全、易操作等特征。
据公开信息,有创测量,即侵入式测量,通常通过将测量探头侵入机体直接与被测对象接触的方式,引导或传感有关生命体的生理和生化参数,故也称直接测量。有创测量会对机体造成一定程度的创伤。而无创测量通常指非侵入式测量,与有创测量相反,通常通过将测量仪器与被测对象皮肤接触等方式,间接引导或传感有关生命体的生理和生化参数,故也称间接测量。此外,有些微创测量的方法,也被称为无创测量。
也即是说,北芯生命“FFR系统”属于“直接测量FFR”,为有创测量,存在一定的风险性。竞争对手润迈德“caFFR系统”与博动医疗“QFR”属于“基于造影计算类的FFR”,为间接测量,采用微创性测量方法,安全性更高。
问题不止于此。
1.6 北芯生命的“FFR系统”诊断准确度为94.3%,低于润迈德的同类产品
据招股书,“FFR系统”临床试验统计结果表明,与使用压力导丝的FFR系统相比,北芯生命“FFR系统”诊断准确度为94.3%,灵敏度为91.3%,特异度为93.8%。
据润迈德招股书,根据“caFFR系统”的临床试验结果,与基于导丝的FFR相比,“caFFR系统”诊断表现显示,诊断准确率为95.7%、敏感性为90.4%及特异性为98.6%。同时,根据润迈德援引数据,“caFFR系统”实现95.7%的高准确度,乃所有国内开发的FFR测量产品中的最高值。
据博动医疗招股书,参考有导丝FFR,博动医疗的“QFR”第一代产品“QFR V1”的诊断准确率为92.4%。
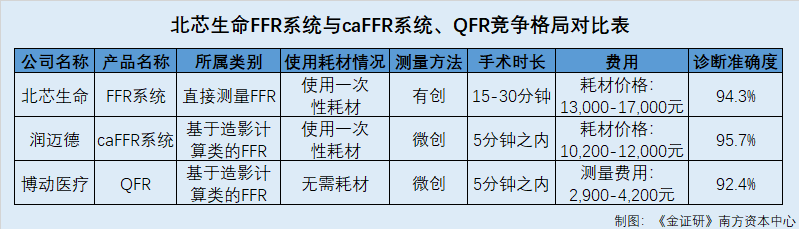
综合上述,根据产品特性,北芯生命“FFR系统”与润迈德“caFFR系统”、博动医疗“QFR”为竞争关系。对比其有创性、手术时间长短、患者自费价格以及诊断准确率四个方面,北芯生命“FFR系统”或均分别落后于竞争对手。在此情况下,北芯生命的竞争地位、市场份额和利润水平等,是否将因此受到影响?
然而,有关北芯生命“FFR系统”的问题才刚刚开始。
二、产品诊断准确度高于临床论文数据,关键技术性能或“蒙眼自嗨”
信息披露无小事。前文提到的诊断准确度,是体现“FFR系统”在临床决策中可靠性的重要指标。
需要指出的是,北芯生命在招股书中披露的“FFR系统”诊断准确度,高于其临床试验论文中的数据及官网产品介绍中的数据,或以此往脸上“贴金”。
2.1 招股书显示,基于压力微导管的测量FFR值的诊断准确度为94.3%
据招股书,2019年8月,北芯生命在国内完成一项前瞻性、多中心对照临床研究,以评估“FFR系统”的有效性及安全性,并将该临床研究作为注册临床试验以申请注册国家药监局三类医疗器械注册证。
本次临床试验入组患者共242名,入组标准为冠脉造影显示冠状动脉狭窄为30%-70%的合格受试者。以上受试者均先后使用基于压力微导管的北芯生命“FFR系统”与基于压力导丝的“FFR系统”进行功能学评估检测及安全性评估,并对评估结果进行统计和对比。
该临床研究的主要终点指标为基于压力微导管的北芯生命“FFR系统”与基于压力导丝的FFR系统测量的FFR值,基于Bland-Altman偏差分析所得FFR结果间的平均偏差,次要终点为两个系统测量结果所体现的诊断性能,包括准确性、敏灵度、特异性及临床显著漂移评估等。
统计结果显示,基于压力微导管的北芯生命“FFR系统”测量FFR值的诊断准确度为94.3%,灵敏度为91.3%,特异度为93.8%。
然而,北芯生命在招股书中所披露的“FFR系统”的诊断准确度,与该临床实验所发表的论文中所披露的诊断准确度矛盾。
2.2 临床试验论文显示,测量值在患者层面的准确度为93.4%低于招股书
据招股书,北芯生命就核心技术平台或通过核心技术平台已发表的主要核心期刊论文共有3篇,其中1篇对应“IVUS系统”产品,2篇对应“FFR系统”产品。
其中1篇对应北芯生命“FFR系统”产品的论文名称为《Multicenter clinical evaluation of a piezoresistive-MEMS-sensor rapid-exchange pressure microcatheter system for fractional flow reserve measurement》,在2021年3月发表于期刊《Catheterization and Cardiovascular Interventions》,论文作者为Chenguang Li、Junqing Yang、Shaohong Dong等15人。
据美国国家医学图书馆国家生物技术信息中心公开信息,《Multicenter clinical evaluation of a piezoresistive-MEMS-sensor rapid-exchange pressure microcatheter system for fractional flow reserve measurement》发表在期刊《Catheter Cardiovasc Interv》上,论文作者为Chenguang Li、Junqing Yang、Shaohong Dong等15人。该论文收录(accepted)的日期为2021年3月16日。
论文内容显示,这项多中心、前瞻性临床研究调查了基于压力微导管的“FFR系统”在FFR测量中是否与基于压力导丝的“FFR系统”一致。该临床试验共招募了242名冠脉造影显示冠状动脉狭窄为30%-70%的患者,其主要终点为基于压力微导管的“FFR系统”和基于压力导丝的“FFR系统”之间Band-Altmen平均偏差,次要终点包括相关性、诊断性能(准确度、灵敏度、特异度)、RC分析和漂移评估。
经对比可知,招股书披露的“FFR系统”的临床试验结果来源于上述论文,以下将该文章统称“临床试验论文”。
“临床试验论文”显示,在242名患者中有239名患者接受了两个系统的FFR测量。在这239名患者中,有224名患者根据临床方案完成了测量。在224名患者中有5名患者在不止一根血管中测量了FFR值,因此产生了229根具有有效FFR测量值的血管。
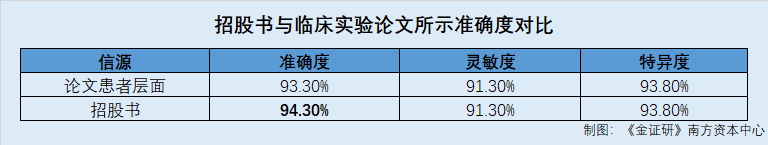
在血管水平,北芯生命“FFR系统”的准确度为93.4%,灵敏度为91.3%,特异度为94%。在患者水平,北芯生命“FFR系统”的准确度为93.3%,灵敏度为91.3%,特异度为93.8%。
而前述提到,招股书中披露的北芯生命“FFR系统”的诊断准确度为94.3%,即“临床试验论文”中无论是在血管水平还是在患者水平,北芯生命“FFR系统”的准确度数据均小于招股书披露的数据。
值得一提的是,“临床试验论文”披露的患者层面的“FFR系统”灵敏度和特异度均与招股书数据一致。
不仅如此,北芯生命官网显示的“FFR系统”准确度也与招股书不一致。
2.3 北芯生命官网与临床试验论文披露的数据一致,诊断准确度均为93.4%
据北芯生命官网,截至查询日2023年7月19日,临床研究对照传统压力导丝与“FFR压力微导管”2种器械测量FFR结果高度一致,准确度高达93.4%。即官网数据与论文数据一致。
简而言之,北芯生命在招股书中披露其“FFR系统”的诊断准确度为94.3%。而“临床试验论文”显示,北芯生命“FFR系统”在血管水平的准确度为93.4%,在患者水平的准确度为93.3%,均小于招股书数据。不仅如此,北芯生命官网产品介绍中显示的“FFR压力微导管”诊断准确度亦为93.4%。
由此可见,北芯生命在招股书中是否“拔高”了FFR诊断准确度,以此提升与同类产品在性能上的竞争优势?其是否存在虚假陈述的嫌疑?或该“打上问号”。
常言道,兵贵神速,对于创新医疗器械类企业来说更是如此,产品的早一天上市便可早一天抢占市场先机。
然而,在行业内的竞争中,北芯生命多个创新性产品的获批上市或“慢半拍”。
3.1 针对血管扩张剂不耐受患者开发“FFR-cRR系统”,预计2023年注册获批
据招股书,阻力恒定期比率(Constant Resistance Ratio,以下简称“cRR”)属于一种瞬时无波期比率(Instantaneous Wave-Free Ratio,以下简称“iwFR”)功能学评估指标,无需使用血管扩张剂即可对冠脉进行功能学评估,已被国际多项大型临床研究证明在诊断心肌缺血和指导PCI治疗策略时与FFR等效,并被欧洲《2018ESC/EACTS心肌血运重建指南》列为IA类推荐。
基于自研的cRR技术,北芯生命推出了具有cRR功能的FFR系统(以下简称“FFR-cRR系统”)。上述cRR功能能够基于现有的“FFR系统”升级和一键切换模式获得。“FFR-cRR系统”在测量时无需使用血管扩张剂,适用于对血管扩张剂不耐受的患者,简化了临床端冠脉功能学评估操作,使直接测量FFR系统适用于更广泛的临床场景。
2020年12月,“FFR-cRR系统”于获得CE认证,并于国内完成大规模的临床试验“FFR系统适应症扩展及cRR注册临床试验”,预计于2023年下半年在国内获批,并完成国家药监局三类医疗器械注册证的更新。
据国家药监局公开信息,截至查询日2023年7月19日,北芯生命共拥有6张国内医疗器械注册证,其中并不包括“FFR-cRR系统”。
也就是说,北芯生命的“FFR-cRR系统”系在现有的“FFR系统”上进行扩展,将实现无需血管扩张药物的冠状动脉功能学快速测量,而该系统将在2023年下半年完成国内注册。
需要指出的是,竞争对手润迈德的“caFFR系统”已经具备无需血管扩张药物的优势。
3.2 竞争对手同类产品已于2020年实现商业化,且无需使用血管扩张剂
据润迈德官网,润迈德产品“caFFR系统”是冠状动脉造影血流储备分数测量系统。该系统具备无需介入操作、无需血管扩张剂等特点。
据润迈德招股书,2019年9月,润迈德“caFFR系统”取得CE认证,次月,润迈德开始在欧洲商业化“caFFR系统”。2019年12月,润迈德“caFFR系统”从国家药监局取得第三类医疗器械的注册证书,2020年1月,润迈德开始在国内商业化“caFFR系统”。
也就是说,竞争对手润迈德的“caFFR系统”,不仅具有无创等特征,还已经具备无需血管扩张剂的优势。
无独有偶,北芯生命另一产品的研发进度,或同样落后于竞争对手。
3.3 北芯生命在研具备IMR功能的“FFR系统”,预计2025年后获批上市
据招股书,微循环阻力指数(Index of Microcirculatory Resistance,以下简称“IMR”)是一种实时测量冠状动脉微循环功能障碍的方法,可量化评估目标冠状动脉位置微循环血管的阻力。IMR建立于现有的FFR技术之上,并扩展至通过评估冠状动脉狭窄远端压力及血液流速而评估微循环功能。FFR及IMR的联合应用可更全面地对冠状动脉的血流功能学进行生理评估。
对此,北芯生命表示,截至招股书签署日2023年3月24日,其在研项目“IMR功能血流储备分数次测量设备和压力微导管研发项目”仍处于设计阶段。该项目将实现冠脉微循环功能障碍疾病的精准诊断,简化冠脉微循环功能障碍测量的操作步骤,联合FFR对冠脉功能学进行更全面的评估,预计于2025年后获得国内获批上市。
然而,润迈德研发的同样功能的产品已于2023年4月注册上市。
3.4 竞争对手具备IMR功能的“caIMR系统”,已于2023年4月获准注册
据润迈德官网,润迈德产品闪影“caIMR系统”(FlashAngio caIMR System,以下简称“caIMR系统”)是非介入式微循环病变诊疗系统,可对冠脉微循环定量测量。
据润迈德2023年4月24日发布的自愿性公告及国家药监局公开信息,2022年4月,润迈德产品“caIMR系统”进入国家药监局创新医疗器械特别审批通道。
据国家药品监督管理局数据,2023年4月20日,“caIMR系统”已获得国家药监局批准注册。
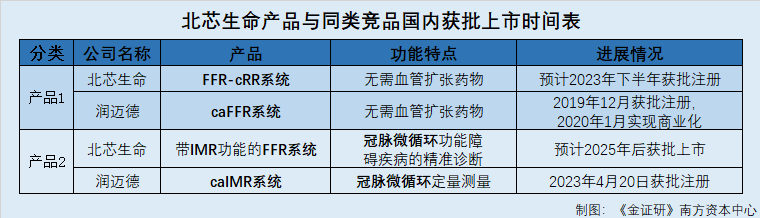
简而言之,北芯生命两款新产品预计在国内注册上市的时间,均晚于润迈德同类产品的注册上市时间,在抢占市场先机方面,北芯生命或“慢半拍”。
在产能利用率未饱和的情况下,企业扩充产能将存在可行性的问题。蹊跷的是,北芯生命的招股书所披露的“FFR压力微导管”产能与环评报告“对垒”。
4.1 招股书显示,主要产品“FFR压力微导管”的最大年产能不超过4万根
前文提到,2020-2021年及2022年1-9月,北芯生命主营业务收入主要来源于“FFR系统”。其中,一次性使用耗材“FFR压力微导管”销售收入占比高企。
据招股书,2020-2021年及2022年1-9月,“FFR压力微导管”的销售收入分别为139.86万元、4,892.58万元、5,922.75万元,占主营业务收入的比例分别为88.09%、94.78%、97.45%。
可见,“FFR压力微导管”为北芯生命贡献了九成的主营业务收入。
关注产能数据。招股书显示,2020-2021年及2022年1-9月,“FFR压力微导管”最大产能分别为0.56万根、3.97万根、3.01万根,实际产量分别为0.19万根、2.43万根、1.95万根,产能利用率分别为34.84%、61.32%、64.83%。
需要指出的是,北芯生命在注解中标明,最大产能系根据报告期各期生产车间产线实际分布、人员安排等情况综合计算得出。
不难发现,北芯生命在招股书中所披露的“FFR压力微导管”产能利用率逐年上升。然而,招股书披露的“FFR压力微导管”的产能数据,与环评文件对垒。
4.2 2021年“坪山制造中心”建成投产,环评文件显示已有6万根“FFR压力微导管”产能
据招股书,2021年末,北芯生命固定资产账面价值较上年末增加1,629.92万元,主要原因系随着经营规模的扩大,规模生产场地“坪山制造中心”2021年建成投产,产线投产所购置生产设备等导致固定资产规模相应增加。
也就是说,北芯生命的规模生产场地“坪山制造中心”已于2021年建成投产。
据广州绿网环境保护服务中心公开信息,“深圳北芯生命科技股份有限公司坪山制造中心项目”(以下简称“坪山制造中心项目”)运营单位为北芯生命,建设地点为深圳市坪山区坑梓街道金沙社区金辉路14号深圳市生物医药创新产业园区1号楼402房。
2021年3月19日,“坪山制造中心项目”得到深圳市生态环境局坪山管理局的环评批复,环评审批文号为深环坪备[2021]092号。2021年10月10日,“坪山制造中心项目”竣工。2021年10月11日至16日,“坪山制造中心项目”环保设施进行调试。该项目的验收检测报告由深圳市同创环保科技有限公司(以下简称“同创环保”)编制,验收报告公开时间为2021年11月6日至11月30日。
通过对比不难发现,“坪山制造中心项目”或为招股书中所披露的规模生产场地“坪山制造中心”。即截至2021年末,“坪山制造中心项目”已经投产,竣工和验收时间分别是2021年10月、2021年11月。
据同创环保2023年5月16日发布的项目公示,“深圳北芯生命科技股份有限公司坪山制造中心扩建项目”(以下简称“扩建项目”)建设单位为北芯生命,建设地址为深圳市坪山区坑梓街道金沙社区金辉路14号深圳市生物医药创新产业园区1号楼402房。
据编制时间为2023年3月的《深圳北芯生命科技股份有限公司坪山制造中心扩建项目环境影响报告表(污染影响类)》(以下简称“环评报告”),因发展需要,北芯生命拟在现有厂房402房扩建生产,并在血管内超声诊断导管与微导管生产工艺中新增油墨印刷、注塑工艺,增加项目产品的灭菌消毒能力。
需要指出的是,“扩建项目”基于现有厂房进行扩建生产,即是说,原有项目的建设地址为深圳市坪山区坑梓街道金沙社区金辉路14号深圳市生物医药创新产业园区1号楼402房。
同时,环评报告显示,2021年3月19日,该项目取得深圳市生态环境局坪山管理局告知性备案回执(深环坪备[2021]092号)。2021年11月,“扩建项目”的原项目对“FFR压力微导管”及其配套的环保设施进行环境保护验收。
对比“扩建项目”的原有项目与“坪山制造中心项目”的建设地址、环评审批文号、验收时间可知,“扩建项目”的原项目与“坪山制造中心项目”或为同一个项目。
关注“坪山制造中心项目”的产能情况。
据“环评报告”,“扩建项目”的原有项目年产压力微导管6万根,血管内超声诊断导管3.6万根,微导管5万根,血流储备分数测量设备1,200台,血管内超声诊断仪1,200台。

根据上述环评文件的信息可见,2021年11月,“扩建项目”的原有项目中的“FFR压力微导管”产线已竣工验收并投产,截至2021年末其压力微导管的年产能已达到6万根。
而招股书披露,2020-2021年及2022年1-9月,“FFR压力微导管”的产能分别为0.56万根、3.97万根、3.01万根。显然,北芯生命在招股书中披露的“FFR压力微导管”的年产能,与环评报告存在出入。
需要说明的是,若按照环评报告披露的年产能,以及招股书披露的产量数据计算,则北芯生命“FFR压力微导管”的产能利用率或将更低。
在此背景下,北芯生命仍计划继续扩产“FFR压力微导管”产品。
4.3 “扩建项目”计划于2023年7月投产,达产后年产能将增至10万根
环评报告指出,“扩建项目”计划于2023年7月投产,扩建后“FFR压力微导管”年产量10万根,“FFR主机”年产量2,400台,血管内超声诊断导管年产量5万根,血管内超声诊断仪年产量2,400台,微导管年产量5万根。
显然,在“扩建项目”投产后,“FFR压力微导管”的年产能将进一步提升。
结合上述情况来看,北芯生命招股书与环评文件披露的“FFR压力微导管”产能数据矛盾,孰真孰假?进一步而言,北芯生命是否涉嫌隐瞒“FFR压力微导管”的真实产能数据?均不得而知。
假作真时真亦假,真作假时假亦真。此番上市,北芯生命能否取得投资者的信任?
免责声明:
本机构撰写的报告,系基于我们认为可靠的或已公开的信息撰写,我们不保证文中数据、资料、观点或陈述不会发生任何变更。在任何情况下,本机构撰写的报告中的数据、资料、观点或所表述的意见,仅供信息分享和参考,并不构成对任何人的投资建议。在任何情况下,我们不对任何人因使用本机构撰写的报告中的任何数据、资料、观点、内容所引致的任何损失负任何责任,阅读者自行承担风险。本机构撰写的报告,主要以电子版形式分发,也会辅以印刷品形式分发,版权均归金证研所有。未经我们同意,不得对报告进行任何有悖原意的引用、删节和修改,不得用于营利或用于未经允许的其它用途。